A tPBM na Doença de Parkinson é um tema de relevância atualíssima. Trata-se de uma das patologias neurodegenerativas mais prevalentes, afetando mais de 10 milhões de pessoas no mundo1. Com o envelhecimento populacional e fatores contemporâneos emergentes, como a exposição a toxinas ambientais (rotenona2 e permetrina3, por exemplo), a incidência da doença em sua forma idiopática está aumentando de forma preocupante.
Atualmente, os tratamentos disponíveis são principalmente sintomáticos, focados na modulação dopaminérgica – uma vez que, quando os sintomas neurológicos aparecem, pode ter havido uma perda entre 50% e 70% dos neurônios dopaminérgicos na substância negra compacta (SNc).4
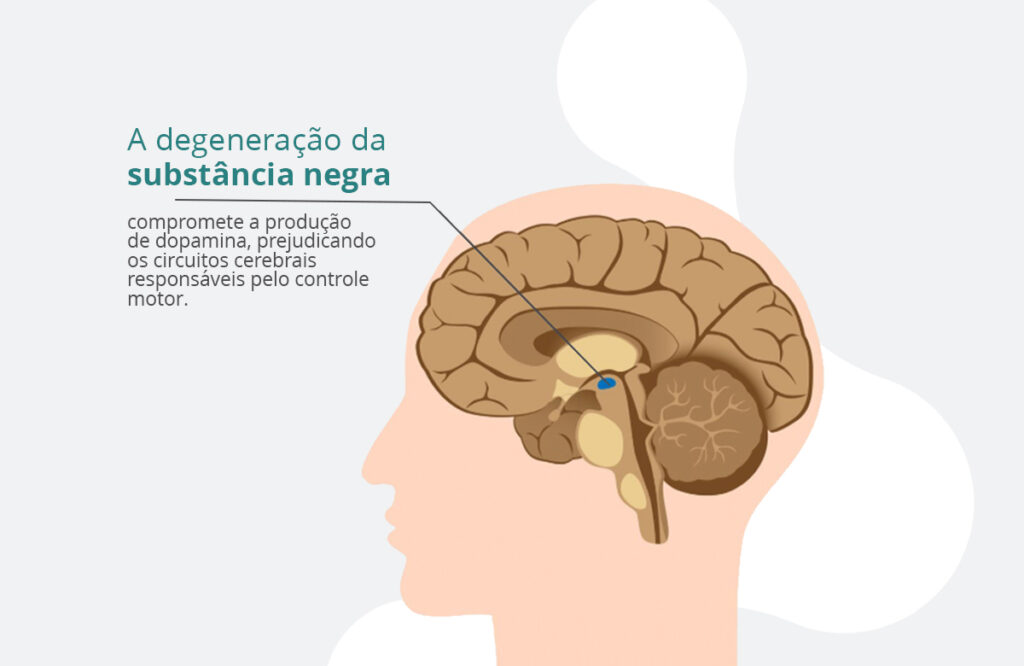
No entanto, esses tratamentos apresentam efeitos adversos significativos, como discinesias, flutuações motoras e complicações neuropsiquiátricas5, estimulando a busca por alternativas terapêuticas eficazes e seguras.
O que é a fotobiomodulação transcraniana (tPBM)?
A fotobiomodulação transcraniana (tPBM) é uma técnica não invasiva que utiliza luz infravermelha próxima (NIR) para modular a atividade celular, particularmente através da estimulação do metabolismo mitocondrial.
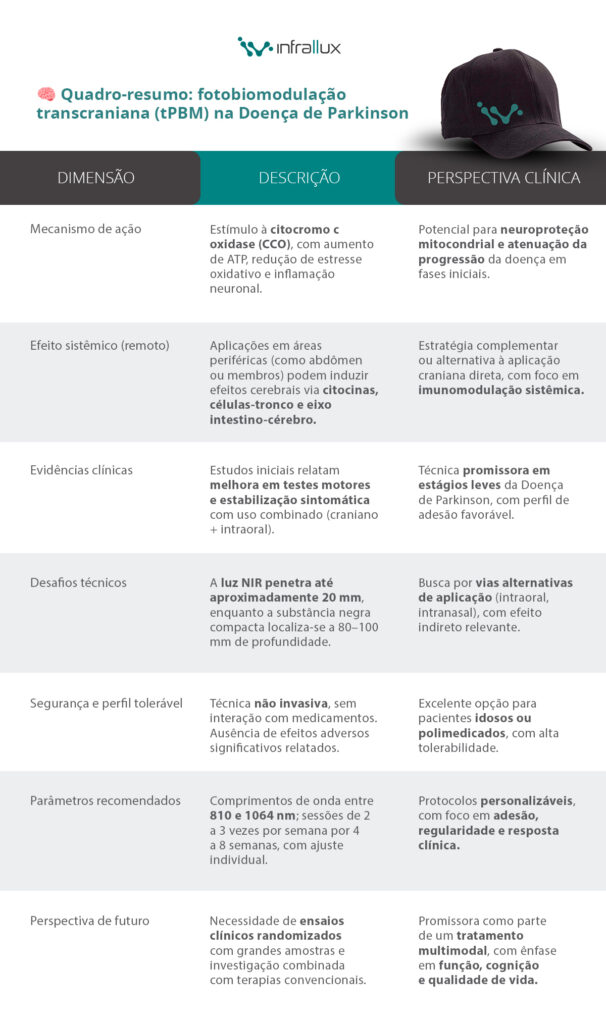
A absorção de energia pela enzima citocromo C oxidase (CCO) promove o aumento da produção de ATP, a redução do estresse oxidativo e a diminuição da inflamação neuronal, melhorias cruciais no contexto da Doença de Parkinson.
Mecanismos de ação da tPBM na Doença de Parkinson
O potencial da tPBM na DP está fortemente ligado à mitigação da disfunção mitocondrial e da neuroinflamação.
O início e a progressão da doença de Parkinson estão relacionados ao acúmulo de mutações no DNA mitocondrial, levando ao aumento da produção de ROS, do estresse oxidativo, do dano mitocondrial, da interrupção da fissão mitocondrial e da autofagia e morte da célula.6
Fonte: BICKNELL, Brian; LIEBERT, Ann; HERKES, Geoffrey. Parkinson’s Disease and Photobiomodulation: Potential for Treatment. Journal of Personalized Medicine, v. 14, n. 1, p. 112, 19 jan. 2024. DOI: 10.3390/jpm14010112. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC10819946/. Acesso em: 22 abr. 2025.
Estudos experimentais em modelos animais demonstraram consistentemente que a exposição ao NIR reduz danos oxidativos, protege neurônios dopaminérgicos na substância negra e diminui significativamente o número de células gliais ativadas, responsáveis por respostas inflamatórias no cérebro7.
Outro mecanismo crucial é o efeito sistêmico do tratamento remoto com tPBM. Estudos pré-clínicos sugerem que aplicações periféricas em áreas distantes da cabeça (por exemplo, abdômen ou pernas) podem desencadear efeitos sistêmicos moduladores, como a ativação de células-tronco mesenquimais, liberação de citocinas anti-inflamatórias e regulação do eixo intestino-cérebro8.
O efeito remoto ou sistêmico da tPBM é uma consequência conhecida do tratamento com PBM em uma parte do corpo, causando um efeito (distal) em outra parte do corpo […].
Fonte: HAMBLIN, Michael R. Mechanisms and applications of the anti-inflammatory effects of photobiomodulation. AIMS Biophysics, v. 4, n. 3, p. 337–361, 19 maio 2017. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28748217/. Acesso em: 22 abr. 2025.
tPBM na Doença de Parkinson: evidências clínicas atuais
Apesar de promissores resultados pré-clínicos, as evidências clínicas em humanos ainda são iniciais, porém encorajadoras. Um estudo de Bullock-Saxton et al. (2021)9, por exemplo, avaliou a aplicação combinada de tPBM craniana e intraoral em pacientes com DP durante quatro semanas.
A terapia combinada, aplicada de 2 a 3 vezes por semana durante pelo menos quatro semanas, resultou em melhorias significativas nas habilidades motoras finas e no equilíbrio dinâmico. Especificamente, os testes da espiral (escrita) e do degrau dinâmico foram os mais sensíveis a mudanças positivas, indicando avanços na coordenação motora e na estabilidade postural.
Em uma revisão recente liderada por Frankowski et al. (2025)10, foi listado um estudo de 201911 em que 55% dos pacientes tratados com NIR (infravermelho próximo) relataram melhorias nos sintomas iniciais da Doença de Parkinson e apenas 2% pioraram, o que destacou o potencial terapêutico substancial da técnica para estabilização dos sintomas.
A ciência já validou. Agora, é a sua vez de aplicar em consultório a luz que protege o cérebro: conheça o capacete Neurollux.
tPBM na Doença de Parkinson: desafios técnicos e penetração da luz
Um dos principais desafios técnicos da aplicação clínica da tPBM na Doença de Parkinson é a penetração adequada da luz na substância negra compacta (SNc), região localizada aproximadamente entre 80 e 100 mm abaixo da sutura coronal. Estudos mostram que a NIR pode penetrar até aproximadamente 20 mm da superfície cortical.12
Assista: Dr. Álvaro Pereira, cirurgião vascular e diretor da Cosmedical, explica como a luz infravermelha próxima (NIR) penetra no crânio
Essa limitação anatômica tem incentivado o desenvolvimento de estratégias indiretas, como aplicação em regiões frontais para modulação do circuito corticoestriatal, ou uso de dispositivos intraorbitais, intranasais e intraorais, que podem atuar em regiões mais profundas por mecanismos de sinalização indireta.
Protocolos clínicos e parâmetros de aplicação
A efetividade da tPBM depende fortemente de parâmetros específicos, como comprimento de onda, potência, duração e frequência das sessões. Estudos pré-clínicos sugerem que variados comprimentos de onda são eficazes13; aqueles entre 810 nm e 1064 nm apresentam melhor absorção mitocondrial e penetração tecidual.
Os protocolos clínicos atuais recomendam tratamentos regulares, geralmente duas a três vezes por semana, por períodos que variam de quatro a oito semanas. No entanto, devido à variabilidade clínica da Doença de Parkinson entre indivíduos, é crucial ajustar os parâmetros individualmente, considerando a resposta clínica e os sintomas específicos apresentados.
Segurança e efeitos adversos
Uma das vantagens significativas da tPBM é seu alto nível de tolerabilidade. Por não envolver metabolismo hepático e interação medicamentosa, a técnica apresenta excelente perfil de segurança.14
Não foram observados efeitos adversos significativos, seja em tratamentos remotos ou com dispositivos transcranianos15, reforçando a viabilidade clínica dessa abordagem terapêutica.
Perspectivas futuras e aplicação na prática clínica
Com base nas evidências atuais, a tPBM emerge como uma das alternativas mais promissoras e inovadoras no manejo da Doença de Parkinson. O potencial para neuroproteção, redução da neuroinflamação e melhora nos sintomas motores e cognitivos oferece uma perspectiva animadora para médicos e pacientes.
Futuras pesquisas clínicas, especialmente ensaios randomizados, controlados e com grandes amostras, são essenciais para determinar parâmetros otimizados de tratamento, definir melhor os mecanismos envolvidos e estabelecer a eficácia a longo prazo dessa abordagem.
Adicionalmente, estudos que avaliem o impacto combinado da tPBM com outras terapias convencionais podem abrir novas frentes de tratamento multidimensional para a Doença de Parkinson.
Solução intraoral para terapias adjuvantes em Parkinson: ILIB sublingual. Seus pacientes pesquisam, seus colegas indicam… E você?
Capacete Neurollux e boné Infrallux: fotobiomodulação transcraniana no consultório e em casa
Com os avanços nas pesquisas sobre fotobiomodulação transcraniana (tPBM), médicos e demais profissionais da saúde já contam com soluções clínicas e domiciliares capazes de integrar essa tecnologia de forma prática e segura aos seus atendimentos.
É nesse contexto que atuam os dispositivos Neurollux e Infrallux, desenvolvidos para atender às diferentes demandas do tratamento neurológico com luz infravermelha próxima (NIR).
O capacete Neurollux é um dispositivo hands-free de uso clínico, ideal para profissionais que desejam incorporar a tPBM em consultório com protocolos personalizados e suporte técnico especializado. É a escolha de referência para neurologistas, psiquiatras, fisiatras, fonoaudiólogos e fisioterapeutas que já acompanham os desdobramentos positivos da tPBM em transtornos neurodegenerativos, transtornos do humor e reabilitação cognitiva.
Já o boné Infrallux foi pensado para a continuidade terapêutica no ambiente domiciliar — essencial em tratamentos que requerem regularidade e alta adesão. Foi desenvolvido em conformidade com os mesmos princípios validados pelas pesquisas apresentadas aqui e permite que o paciente mantenha o tratamento com autonomia, conforto e seguindo a orientação médica.
Neurollux e Infrallux colocam em suas mãos o que há de mais avançado em estimulação cerebral não invasiva.
Este é o momento de transformar evidência em ação — e oferecer aos seus pacientes um novo paradigma no cuidado neurológico para a Doença de Parkinson.
🔗 Profissional de saúde, fale aqui com nosso consultor técnico e solicite uma demonstração personalizada.
Este artigo foi elaborado com base nas evidências atuais em neurociência e destina-se a fornecer informações detalhadas sobre a evolução e o manejo da Doença de Parkinson. Sempre consulte um profissional de saúde para diagnóstico e tratamento individualizados.
Você também vai gostar de ler
- FAQ: Boné Infrallux
- Fotobiomodulação transcraniana e Alzheimer
- Fotobiomodulação transcraniana e TEA (Transtorno do Espectro Autista)
- Fotobiomodulação transcraniana e paralisia cerebral
- Fotobiomodulação transcraniana e Parkinson
Referências bibliográficas I
1. PARKINSON’S FOUNDATION. Statistics. Disponível em: https://www.parkinson.org/understanding-parkinsons/statistics. Acesso em: 22 abr. 2025.
2. LAWANA, V.; CANNON, J.R. Rotenone neurotoxicity: relevance to Parkinson’s disease. In: Advances in Neurotoxicology. v. 4. Elsevier, Amsterdam, The Netherlands, 2020. p. 209–254.
3. PAUL, K.C.; RITZ, B. Epidemiology meets toxicogenomics: mining toxicologic evidence in support of an untargeted analysis of pesticides exposure and Parkinson’s disease. Environmental International, v. 170, 2022.
4. CHENG, H.C.; ULANE, C.M.; BURKE, R.E. Clinical progression in Parkinson disease and the neurobiology of axons. Annals of Neurology, v. 67, 2010.
5. GANDHI, K.R.; SAADABADI, A. Levodopa (L-Dopa). In: STATPEARLS [Internet]. StatPearls Publishing, St. Petersburg, FL, USA, 2022. Disponível em: https://www.statpearls.com. Acesso em: 22 abr. 2025.
6. BICKNELL, B.; LIEBERT, A.; HERKES, G. Parkinson’s Disease and Photobiomodulation: Potential for Treatment. PMC, 2025. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC10819946. Acesso em: 22 abr. 2025.
7. SAN MIGUEL, M.; MARTIN, K.L.; STONE, J.; JOHNSTONE, D.M. Photobiomodulation mitigates cerebrovascular leakage induced by the Parkinsonian neurotoxin MPTP. Biomolecules, v. 9, n. 10, 2019. Disponível em: https://www.mdpi.com/2218-273X/9/10/564. DOI: 10.3390/biom9100564. Acesso em: 22 abr. 2025.
8. GORDON, L.C. et al. Remote photobiomodulation targeted at the abdomen or legs provides effective neuroprotection against parkinsonian MPTP insult. European Journal of Neuroscience, v. 57, 2023, p. 1611–1624.
Referências bibliográficas II
9. BULLOCK-SAXTON, J. et al. Exploring the effect of combined transcranial and intra-oral photobiomodulation therapy over a four-week period on physical and cognitive outcome measures for people with Parkinson’s disease: a randomized double-blind placebo-controlled pilot study. PubMed, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34092640/. Acesso em: 22 abr. 2025.
10. FRANKOWSKI, D.W. et al. Light buckets and laser beams: mechanisms and applications of photobiomodulation (PBM) therapy. PubMed, 2025. Disponível em: https://pubmed.ncbi.nlm.nih.gov/39826026/. Acesso em: 22 abr. 2025.
11. HAMILTON, C.L. et al. “Buckets”: early observations on the use of red and infrared light helmets in Parkinson’s disease patients. Photobiomodulation, Photomedicine, and Laser Surgery, v. 37, n. 10, 2019, p. 615–622. Disponível em: https://europepmc.org/article/med/31536464. Acesso em: 22 abr. 2025.
12. NAIRUZ, T. et al. Photobiomodulation therapy on brain: pioneering an innovative approach to revolutionize cognitive dynamics. PubMed, 2025. Disponível em: https://pubmed.ncbi.nlm.nih.gov/38891098/. Acesso em: 22 abr. 2025.
13. REINHART, F. et al. The behavioural and neuroprotective outcomes when 670 nm and 810 nm near infrared light are applied together in MPTP-treated mice. ScienceDirect, 2016. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0168010216302528. Acesso em: 22 abr. 2025.
14. WOŹNIAK, J. et al. Near-infrared stimulation in psychiatry disorders: a systematic review of efficacy and biological mechanisms. NeuroSci, v. 6, n. 1, 2025. Disponível em: https://www.mdpi.com/2673-4087/6/1/26. Acesso em: 22 abr. 2025.
15. BICKNELL, B. et al. Parkinson’s disease and photobiomodulation: potential for treatment. Journal of Personalized Medicine, v. 14, n. 1, 2024, p. 112. DOI: 10.3390/jpm14010112. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC10819946/. Acesso em: 22 abr. 2025.



